Le système immunitaire adaptatif repose sur un immense répertoire de récepteurs codés par des segments de gènes réarrangés, et synthétisés par les lymphocytes. Cette réponse se caractérise par sa spécificité, l’expansion clonale des lymphocytes concernés, et la mémoire d’une immunisation primaire. Cette réponse n’est pas immédiatement efficace si l’organisme n’a pas été préimmunisé. Pourtant, chez un individu sain, la plupart des agents pathogènes sont rapidement détectés et éliminés par des mécanismes de défense efficaces qui pré-existent à l’introduction de l’agent infectieux dans l’organisme. Ces mécanismes, regroupés sous le terme de « système immunitaire inné », jouent deux rôles fondamentaux : (1) ils constituent la première ligne de défense contre les infections ; (2) ils activent la réponse immunitaire adaptative. Leur intervention est immédiate car ils ne reposent pas sur l’expansion clonale de lymphocytes spécifiques d’un antigène, mais mettent en jeu des récepteurs codés par des gènes qui ne subissent pas de réarrangements somatiques. Ces récepteurs, présents à la surface de cellules effectrices ou sous forme soluble, sont capables de reconnaître des composants présents chez les organismes infectieux, appelées PAMP pour pathogen associated molecular patterns [1]. Les PAMP correspondent à des structures relativement invariantes, présentes généralement sur l’enveloppe des procaryotes et des champignons, mais absentes chez l’hôte. Cette caractéristique fait des PAMP une signature de l’infection. Parmi les PAMP, nous pouvons citer le lipopolysaccharide (LPS), les peptidoglycanes, les mannanes que l’on trouve à la surface de divers micro-organismes, mais aussi l’ARN doublebrin et l’ADN bactérien. Les récepteurs capables de détecter la présence d’agents infectieux via les PAMP ont été appelés pattern recognition receptors (PRR) [1]. Dès lors, la discrimination microbienne par les PRR s’établit plutôt entre des classes de pathogènes (par exemple les bactéries à Gram négatif par la détection du LPS). Si les facteurs impliqués dans la réponse immunitaire innée sont relativement bien caractérisés, les molécules qui repèrent les agents infectieux et qui contrôlent l’expression de ces facteurs n’avaient pas été identifiées jusqu’à récemment. Une famille de récepteurs transmembranaires conservés au cours de l’évolution semble fonctionner comme PRR. Ces récepteurs, connus sous le nom de Toll-like-receptors (TLR) ont été décrits pour la première fois chez la drosophile, où le récepteur Toll induit la production de petits peptides à activité anti-fongique en réponse à des infections fongiques [2] (→). Chez les mammifères, il existe une grande famille de TLR (10 membres au moins) dont certains sont impliqués dans la reconnaissance de PAMP. TLR-4 est nécessaire pour la réponse inflammatoire qu’induit la présence de LPS. TLR-3 détecterait l’ARN double-brin, de manière directe ou indirecte, permettant de signaler la présence de nombreux virus. TLR-5 a été impliqué dans la détection de bactéries flagellées en se liant à la flagelline, le constituant principal de leur flagelle. TLR-9 reconnaîtrait l’ADN bactérien, un autre PAMP, très souvent utilisé comme adjuvant. Enfin, TLR-2 est activé par de nombreux PAMP, comme les lipoprotéines ou les peptidoglycanes. La fixation de ligands sur ces récepteurs converge vers l’activation du facteur de transcription NF-κB qui contrôle l’expression de nombreux médiateurs et effecteurs de l’immunité innée (pour revue, voir [3]).
(→) m/s 2000, n°12, p.1439
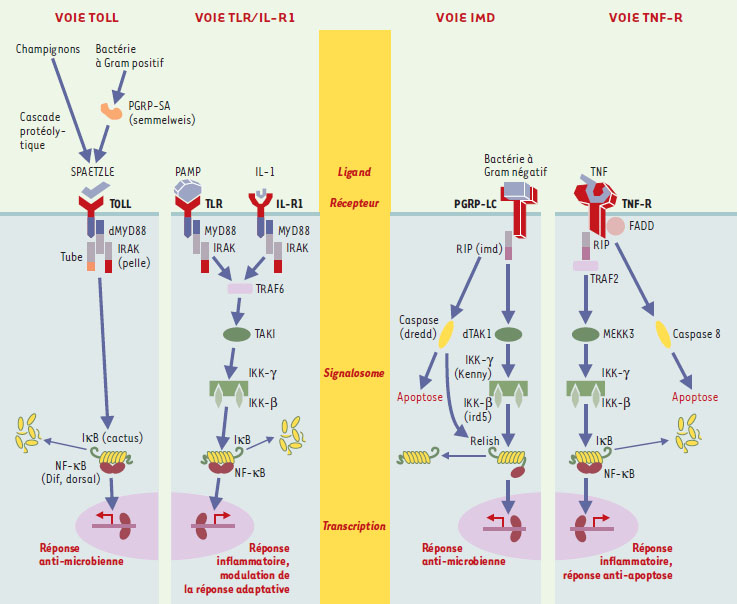
Les molécules intervenant dans cette étape initiale détectant la présence des micro-organismes sont très conservées chez Drosophila melanogaster (pour revue, voir [4]). Dans le corps gras de la mouche (un tissu fonctionnellement équivalent au foie des mammifères), deux voies de signalisation distinctes contrôlent la synthèse des peptides antimicrobiens. La voie « Toll » répond à la présence des bactéries à Gram positif et des champignons. La voie « Imd » signale la présence des bactéries à Gram négatif. Ces deux voies de signalisation partagent de nombreuses similitudes avec les voies de signalisation respectives TLR/IL-1R (interleukin-1 receptor) et TNF-α (tumor necrosis factor α) des mammifères (Figure 1). Cependant, et contrairement à ce qui se passe chez les mammifères, aucune des protéines de la famille Toll de la drosophile ne semble jouer le rôle de PRR.
| Figure 1. Conservation fontionnelle et structurelle entre la réponse immunitaire humorale de la drosophile et la réponse immunitaire innée des mammifères. La voie de signalisation « Imd » de la drosophile qui signale la présence des bactéries à Gram négatif partage de nombreuses similitudes avec la voie de signalisation TNFα-R des mammifères. Des composants de la voie « Toll » qui répond à la présence des bactéries à Gram positif et des champignons sont présents dans les voies de signalisation TLR/IL-R1 des mammifères. |
Afin de mieux comprendre la reconnaissance et la phagocytose des bactéries chez la drosophile, nous avons entrepris le criblage de son génome dans une lignée cellulaire pro-macrophage en utilisant à grande échelle une méthode d’inactivation génique appelée double-strand RNA interference (RNAi)[5] (→). Cette méthode éteint efficacement et de manière spécifique l’expression d’un gène dans les cellules macrophagiques que nous avons choisies [6]. Nous avons sélectionné au hasard dans une banque d’ADN complémentaire (ADNc) un échantillon de 1 000 ADNc et, après le traitement des cellules par le RNAi correspondant, nous avons testé les conséquences de cette manipulation sur la reconnaissance et la phagocytose de Escherichia coli (Gram négatif) et de Staphylococcus aureus (Gram positif) par ces cellules. Nous avons ainsi identifié 34 gènes dont les produits sont essentiels pour une phagocytose optimale [7]. Ces gènes participent à diverses fonctions : développement des cellules sanguines, transport cytoplasmique des vésicules intracellulaires, contrôle de la réorganisation du cytosquelette d’actine, mais un seul de ces 34 gènes correspond à un récepteur membranaire, appelé peptidoglycan receptor protein LC (PGRP-LC). Contrairement aux 33 autres gènes, il s’avère que PGRP-LC est impliqué dans la phagocytose de E.coli mais pas de S. aureus. Une hypothèse possible était que PGRP-LC soit requis pour l’expression des gènes codant pour les peptides antibactériens actifs contre ce type de bactérie, et représente le récepteur qui informe la cellule et déclenche la réponse aux bactéries à Gram négatif à travers la voie « Imd », ce récepteur étant jusqu’alors inconnu. L’hypothèse s’est avérée juste : après infection avec E. coli ou après traitement par le LPS, nous avons pu montrer que, in vitro et in vivo, PGRP-LC est effectivement nécessaire à la synthèse des peptides antimicrobiens qui dépendent de la voie « Imd », mais pas de ceux qui dépendent de la voie « Toll ». De plus, les mouches mutantes pour PGRP-LC présentent une sensibilité accrue aux bactéries à Gram négatif mais une résistance normale à une infection par des bactéries à Gram positif. Ces résultats, obtenus indépendamment dans les laboratoires de Jules Hoffmann et de Kathryn Anderson [8, 9], indiquent que PGRP-LC est un composant essentiel pour détecter, signaler et éradiquer les infections dues à des bactéries à Gram négatif, et agit probablement comme un récepteur transmembranaire de la voie « Imd ».
(→) m/s 2001, n°3, p. 355 et 2002, n°6-7, p. 665
Les premiers membres de PGRP furent identifiés chez le papillon Trichoplusia ni [10] et le ver à soie Bombyx mori [11], mais d’autres membres ont été isolés chez la mouche [12], la souris et l’homme [10]. Les différents PGRP existent sous une forme transmembranaire et soluble, sécrétée. Initialement, ces molécules ont été caractérisées par leur propriété de reconnaître et de fixer les bactéries à Gram positif (chez lesquelles les peptidoglycanes sont les composants majeurs de la membrane) [10]. Récemment, Royet et al. ont montré que des mutations perte de fonction dans le gène semmelweis (qui code pour une forme sécrétée d’un autre PGRP, PGRP-SA) diminuent la résistance des mouches mutantes uniquement à une infection par des bactéries à Gram positif et bloquent l’activation de la voie « Toll » [13] (→). Cependant, nos travaux et ceux d’autres laboratoires montrent qu’une unique fonction de reconnaissance des peptidoglycanes semble trop restrictive et que le spectre de reconnaissance des PGRP peut être étendu aux bactéries à Gram négatif. Par ailleurs, il est intéressant de noter que les PGRP peuvent activer les voies de signalisation par des mécanismes différents : PGRP-SA, sous forme soluble, active la voie « Toll », PGRP-LC, sous forme transmembranaire, active la voie « Imd ». Il existe 11 autres PGRP chez la drosophile, et il est probable que certains d’entre eux participent à la reconnaissance d’autres micro-organismes (parasites, champignons, virus). En conclusion, plusieurs études très récentes clarifient les moyens par lesquels la drosophile détecte et signale la présence d’agents infectieux. Elles dirigent l’attention sur les 4 PGRP identifiés chez l’homme et sur leur rôle au cours de la réponse immunitaire innée [14]. En effet, malgré les énormes progrès réalisés dans ce domaine, la lutte contre les infections demeure un problème médical majeur. L’invasion de l’organisme par un agent infectieux, quelle qu’en soit la nature, avec ou sans septicémie, entraîne des réactions inflammatoires en cascade dont les effets potentialisateurs sont responsables d’effets délétères sur le système cardiovasculaire et d’autres organes cibles (exemple du choc septique). Ainsi, l’étude des mécanismes de la reconnaissance des micro-organismes présente non seulement un intérêt scientifique théorique, mais constitue un réel défi pour le traitement des infections et de leurs complications.
(→) m/s 2000, n°12, p. 1439